カンナビノイド含有量に対する粉砕の影響
さまざまな粉砕装置と条件を比較し、さまざまな粉砕プロトコルがカンナビノイドの回収に与える影響を調査しました。Dingding Xuan、Sajni Shah、Amanda Assen、Eric Janusson 博士、Markus Roggen 博士は、使い捨て容器を備えたメッサーミル PULVERISETTE 11は、カンナビノイドの回収率が同等に高いことに加え、交差汚染を防ぎ、洗浄時間とコストを削減できるという利点もあると研究で結論付けました。
XD022, XD023 – Cannabis milling comparison experiments
Dingding Xuan, Sajni Shah, Amanda Assen, Dr. Eric Janusson, Dr. Markus Roggen
概要
さまざまな粉砕装置と条件を比較し、さまざまな粉砕プロトコルがカンナビノイドの回収に与える影響を調査しました。使い捨て容器を備えたメッサーミル PULVERISETTE 11は、同等のカンナビノイド回収率を示し、交差汚染を防ぎ、洗浄時間とコストを削減するという追加の利点があることがわかりました。
序論
大麻の安全性と一貫性の検査は、(ドイツ国内では)合法大麻システムの基盤です。他の農作物と比較して、大麻の検査には特定の独自の課題があります。一般的に、大麻の花は、最適な分析対象物の回収のために、抽出前に粉砕する必要があります。サンプルの粉砕は、プロセス最適化研究で見落とされがちなステップです。大麻の花の粉砕に関する研究では、 THC テトラヒドロカンナビノール:大麻の主な有効成分 の超臨界 CO2 抽出に最適な粒子サイズ*1 と、長時間の粉砕で発生する熱と酸性カンナビノイドの脱炭酸との関係が調査されています。*2 たとえば、Caleb Proctor らは、サンプル温度が 90 °C 未満に維持されている限り、ビーズ粉砕による最大 120 秒間の均質化では CBDA カンナビジオール酸:鎮痛作用や気分の向上 と THCA テトラヒドロカンナビノール酸:THCの前駆体 の脱炭酸は起こらないことを示しました。*2 ただし、これまでのところ、大麻または関連植物抽出物の分析対象物の回収に対する粉砕方法の影響に関する研究は報告されていません。
業界全体で、カンナビノイド抽出手順はさまざまです。電動ブレードミル、乳鉢と乳棒、ボールミル、極低温ミル、ブレードミル、その他多くの方法が利用可能ですが、ほとんどの研究室では、植物分析に小規模な手挽きまたは電動ミル/コーヒーグラインダーを使用しています。大麻業界向けに販売されている電動ミルは数多くありますが、そのパラメータは分析対象物の保存に最適な条件について評価されていません。したがって、サンプル調製ワークフローの標準的な手順がカンナビノイドの定量精度にどのように影響するかを理解し、方法を最適化することが私たちの目標でした。私たちの知る限り、カンナビノイドの回収に関するデータを提示しているミル/グラインダー製造業者は他にありません。
粉砕が測定精度に与える影響を評価するために、さまざまな条件下で粉砕した大麻抽出物のカンナビノイド含有量を測定しました。具体的には、電動ブレードミル(通常はコーヒー粉砕に使用)と、さまざまな粉砕容器(使い捨て容器と 1.4L 容器)を備えた メッサーミル PULVERISETTE 11 (P11)を使用して、 THCA テトラヒドロカンナビノール酸:THCの前駆体 と CBDA カンナビジオール酸:鎮痛作用や気分の向上 の大麻の花をさまざまな速度で粉砕しました。
実験
2 種類のカンナビス サティバ栽培品種 ( THC テトラヒドロカンナビノール:大麻の主な有効成分 および CBD カンナビジオール:鎮痛、抗炎症作用などの効果 が豊富) を Valens (ブリティッシュ コロンビア州ケロウナ) から入手し、実験室の常温で暗所に保管しました。電動ブレードミル (コーヒー グラインダー) と メッサーミル PULVERISETTE 11 (P11) を使用して、2 種類の花栽培品種をさまざまな粉砕条件 (粉砕速度と時間) で均質化しました。粒子はサイズ分けされ、超音波処理による HPLC グレードのメタノールで抽出されました。ろ過および希釈した抽出物は HPLC-VWD で分析され、カンナビノイドが定量化されました。
サンプルの準備
粉砕処理
以下の手順は、それぞれ THC テトラヒドロカンナビノール:大麻の主な有効成分 および CBD カンナビジオール:鎮痛、抗炎症作用などの効果 大麻花に対して実施されました。
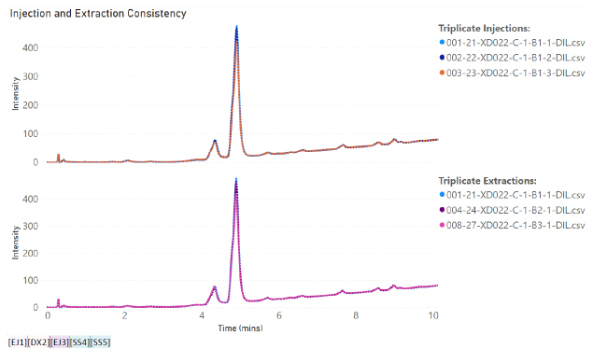
大麻の花約 3 g の 3 重サンプルを計量し、表 1 に記載されているパラメータに従って粉砕しました。電動ブレードミルと P11 粉砕容器は、交差汚染を避けるために、粉砕の合間に洗浄されました。
粉砕した花のサンプル約 0.75 g を採取し、粒度分析を行いました (詳細は補足情報を参照)。さらに、粉砕したサンプル 3 部 (250 ~ 400 mg) を抽出用に測定しました。各サンプルに 4 mL の MeOH を加え、ボルテックスで撹拌した後、15 分間超音波処理しました。液体は 0.2 μm ナイロン フィルターでろ過し、オートサンプラー バイアルに採取しました。
表 1. 大麻花の粉砕パラメータ: 大麻花は、電動ブレードミルまたは メッサーミル PULVERISETTE 11 (P11) を使用して粉砕されました。サンプル ID はバッチ番号と反復番号を表します。
| Mill Type | Parameters | Smaple ID |
|---|---|---|
| coffee grinder | 20s, continuous | XD022-T-1 (XD022-C-1) |
| coffee grinder | 20s, pulses (3s on, 2s off) | XD022-T-2 (XD022-C-2) |
| P11 with single-use grinding vessel | 2000rpm, 20s | XD022-T-3 (XD022-C-3) |
| P11 with single-use grinding vessel | 4000rpm, 10s | XD022-T-4 (XD022-C-4) |
| P11 with single-use grinding vessel | 2000rpm, 10s | XD022-T-5 (XD022-C-5) |
| P11 with 1.4L grinding vessel | 2000rpm, 20s | XD022-T-6 (XD022-C-6) |
注: サンプルIDのTはTHCAフラワー、CはCBDAフラワーを表します。
分析
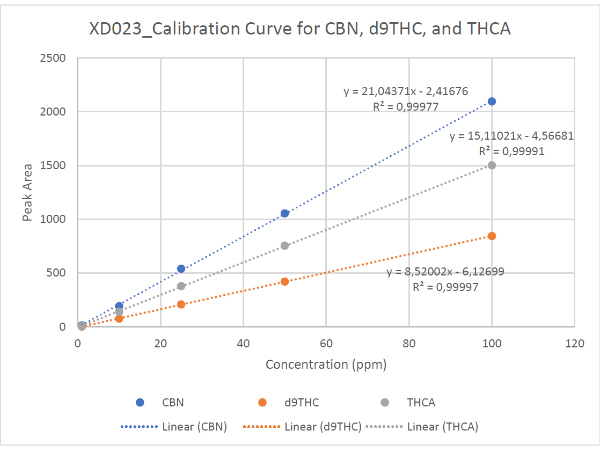
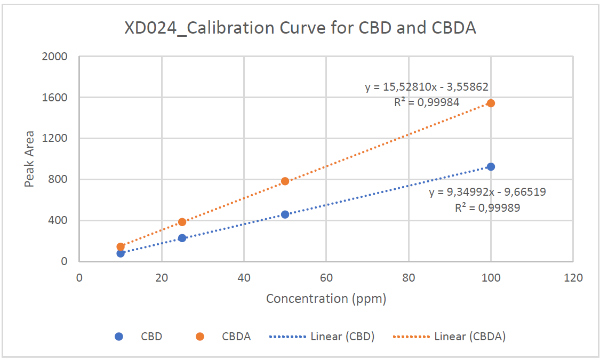
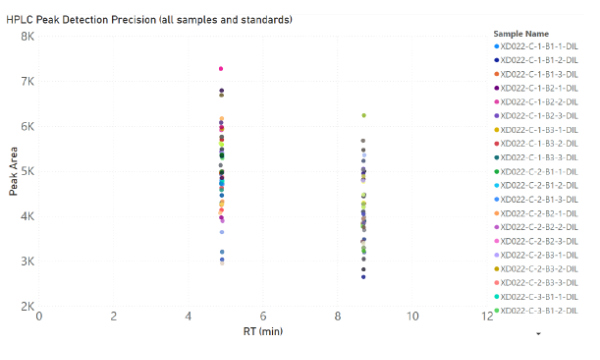
すべてのサンプルは、HPLC液体中の成分を分離・定量分析する分析装置 分析のためにメタノールで 25 倍に希釈されました (1.00 mL MeOH に 40 uL のサンプル)。サンプルは、230 nm を監視するように設定された可変波長検出器を備えた Agilent 1220 HPLC で分析されました。カンナビノイドの定量に使用された RP-HPLC プログラムの詳細な説明は、補足情報に記載されています。
結果
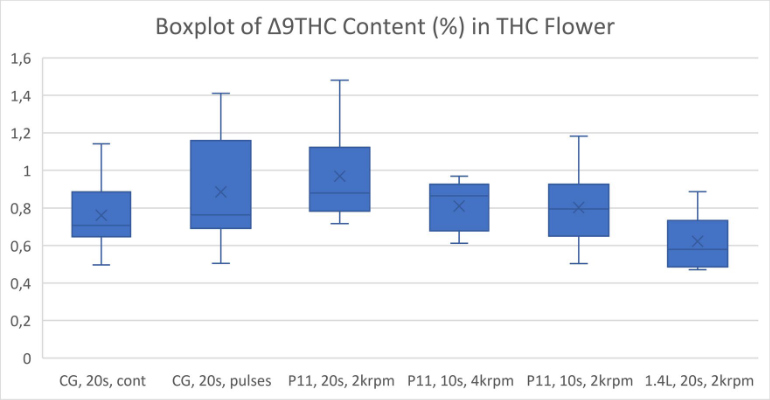
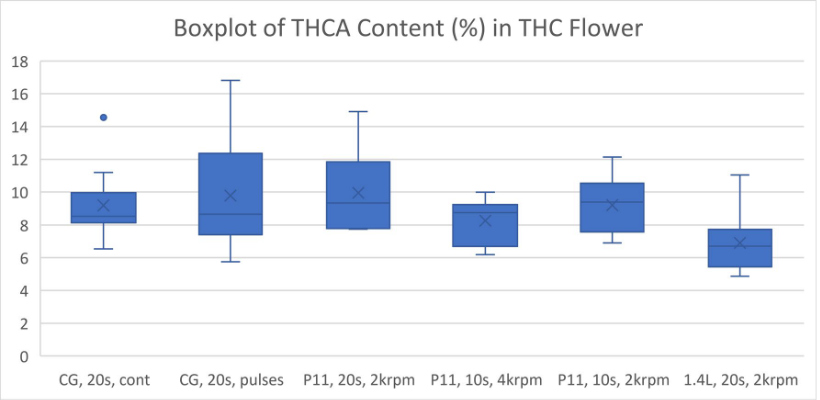
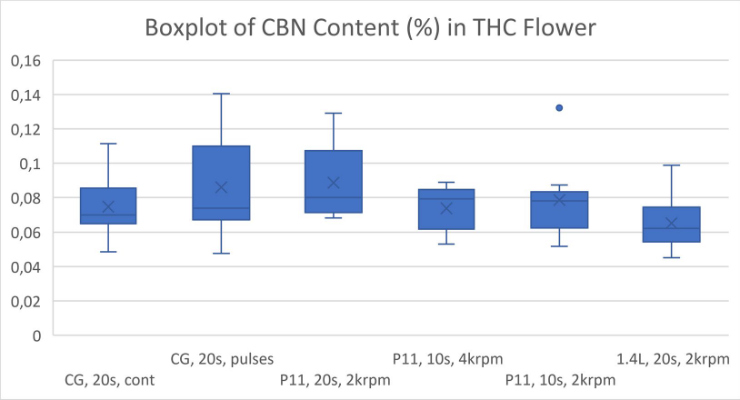
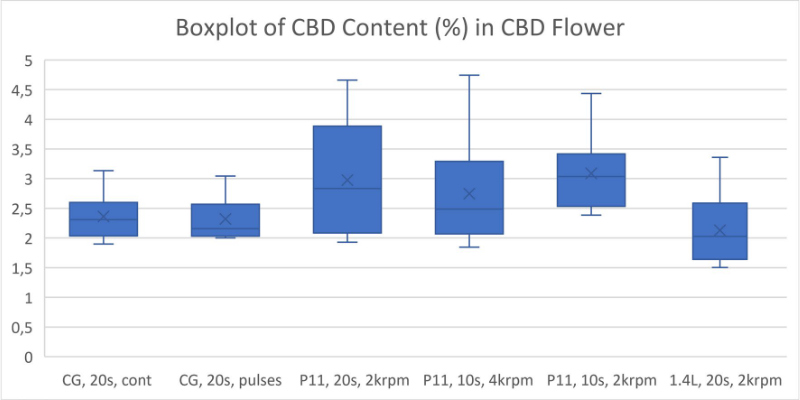
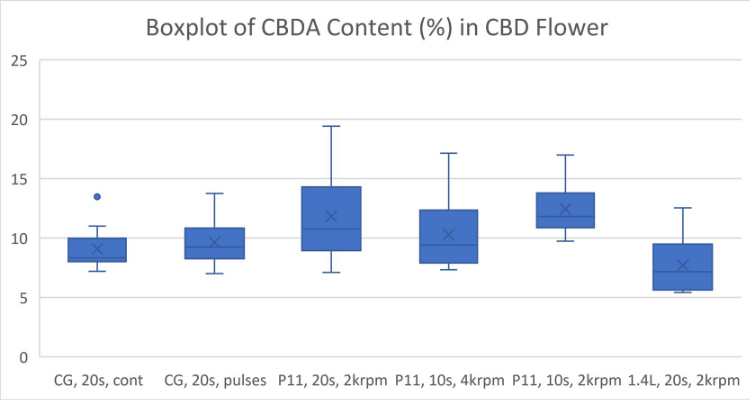
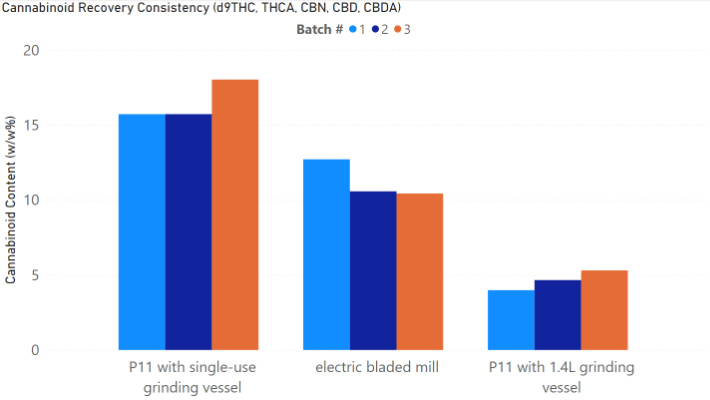
全体的に、より強力な粉砕条件では、おそらく熱分解により、カンナビノイドが失われることがわかりました (図 1-5)。ブレードミルで 20 秒間パルス処理し、使い捨て容器で P11 を使用して 2krpm で 20 秒間粉砕した高 THC 大麻は、最高濃度の Δ9-THC をもたらしました (図 1)。高 CBD 大麻からの最高の CBD 収量は、P11 と使い捨て容器を使用して 2krpm で 20 秒間粉砕した花から得られました (図 2)。高 THC 大麻からの最高の CBN および THCA 収量は、ブレードミルで 20 秒間パルス処理し、使い捨て容器で P11 を使用して達成されました (図 3 および 4)。最後に、高 CBD 大麻からの最高の CBDA 収量は、P11 使い捨て容器を使用して 2krpm で 20 秒と 10 秒で達成されました (図 5)。
結果から、使い捨て容器の使用はカンナビノイドの損失と相関関係がないことがわかっています。実際、容器は、電動ブレードミルや 1.4L 粉砕容器を備えた P11 よりも、Cannabis Sativa 抽出物で検出されたカンナビノイドの回収に有利です。ブレードミルに対する Fritsch P11 ミルの利点は、P11 で設定できる粉砕パラメータのコントロールが追加されていることです。使い捨て容器で P11 を使用すると、サンプル間の交差汚染の可能性を防ぎ、サンプル間の衛生管理に必要な時間と作業を削減できるため、大きな利点があります。全体として、使い捨て粉砕容器を備えた メッサーミル PULVERISETTE 11は、少ない労力で高いカンナビノイド回収を達成したい人にとって優れた選択肢です。
参考文献
- Eöry, L., Béla Dános & Tibor Veress. SUPERCRITICAL FLUID EXTRACTION OF TETRAHYDROCANNABINOL FROM MARIHUANA STUDY OF THE EFFECT OF PARTICLE SIZE. Institute for Forensic Sciences, Budapest, Hungary 47, 322–327 (2001).
- Proctor, C., Soldat, S., Easparro, B., Nash, R. & Atwood, J. The Decarboxylation Myth – Does Cannabis Homogenization by Bead Milling Result in Cannabinoid Decarboxylation? https://www.researchgate.net/profile/Brandon-Easparro/publication/329629388_The_Decarboxylation_Myth-Does_Cannabis_Homogenization_by_Bead_Milling_Result_in_Cannabinoid_Decarboxylation/links/5c12ba19299bf139c756bee8/The-Decarboxylation-Myth-Does-Cannabis-Homogenization-by-Bead-Milling-Result-in-Cannabinoid-Decarboxylation.pdf.
補足情報
カンナビノイド定量のためのRP-HPLC法
序論
以下は、カンナビノイドの定量と分離に適したグラジエント RP-HPLC 法です。サンプルには、精製された大麻抽出物やその他の精製製品が含まれる場合があります。
記事
オクタデシルシリカ(C18、Agilent Poroshell 2.1 um、50 x 150 x 300 mm)
溶離液
いずれの場合も、HPLC グレードの溶媒を使用し、30 分/L 超音波処理して脱ガスする必要があります。
- A: 1% (v/v%) メタノール、0.1% ギ酸を含む脱イオン水 (DI)
- B: メタノール、0.1% ギ酸
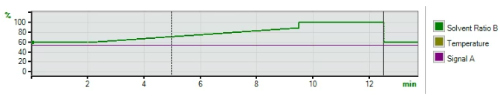
Gradient Pump
| Time (mins) | A (%) | B (%) | Flow (mL/min) | Max Pressure (bar) |
|---|---|---|---|---|
| 0.00 | 40 | 60 | 1 | 400 |
| 2.00 | 40 | 60 | 1 | 400 |
| 9.50 | 11 | 89 | 1 | 400 |
| 9.51 | 0 | 100 | 1 | 400 |
| 12.50 | 0 | 100 | 1 | 400 |
| 15.00(posttime) | 40 | 60 | 1 | 400 |
機器とデータ補足
| Column Oven(℃) | VWD (nm) | Injection Volume (µm) | Needle Wash Pos. |
|---|---|---|---|
| 55.0 | 220 | 5 | 100 |